Informaţii privind retragerea dispozitivelor medicale
Dispozitive Philips Respironics Sleep and Respiratory Care (pentru terapie respiratorie şi de somn)
Informaţii pentru clinicieni, toate într-un singur loc
În luna iunie 2021, după ce a descoperit un potenţial risc pentru sănătate legat de o parte din anumite dispozitive CPAP (dispozitive cu presiune pozitivă continuă a căilor respiratorii), BiPAP (dispozitive cu presiune respiratorie pozitivă bi-nivel) şi ventilatoare mecanice, Philips a emis un notă de atenționare voluntară privind siguranța la locul de utilizare (în afara Statelor Unite) / o notificare de retragere voluntară (doar în Statele Unite).
Ne angajăm să sprijinim clinicienii pe parcursul procesului de remediere completă şi vom asigura o serie de resurse pentru a vă ajuta să informaţi, instruiţi şi sprijiniţi mai bine pacienţii dumneavoastră. Nu uitaţi să vizitaţi această pagină în mod regulat pentru cele mai recente informaţii pentru dumneavoastră şi pacienţii dumneavoastră.
Vă mulţumim pentru răbdare şi pentru încrederea constantă.
Resurse
Am rugat pacienţii dumneavoastră să ia următoarele măsuri:




Apelaţi numărul 0800-672533
Noutăţi şi actualizări
Toate actualizările pentru clinicieni
-
![Resurse pentru clinicieni şi medici]()
-
![Philips oferă informaţii actualizate despre programul de testare şi cercetare]()
Philips oferă informaţii actualizate despre programul de testare şi cercetare
December 23, 2021
Află mai multe -
![Instrucţiuni de curăţare şi de inspecţie pentru accesoriile existente]()
Instrucţiuni de curăţare şi de inspecţie pentru accesoriile existente
September 3, 2021
Află mai multe -
![Philips începe programul de reparare şi/sau înlocuire al dispozitivelor DreamStation de primă generaţie]()
Philips începe programul de reparare şi/sau înlocuire al dispozitivelor DreamStation de primă generaţie
September 1, 2021
Află mai multe -
![Un mesaj de la David Ferguson]()
Următoarele produse listate sunt afectate de notificarea de retragere/avizul privind siguranţa la locul de utilizare:
Dispozitive CPAP şi BiLevel PAP
Toate dispozitivele afectate fabricate înainte de 26 aprilie 2021, toate numerele de serie ale dispozitivelor
Ventilator cu funcţionare continuă, Suport minim al ventilatorului, Utilizare în instituţie
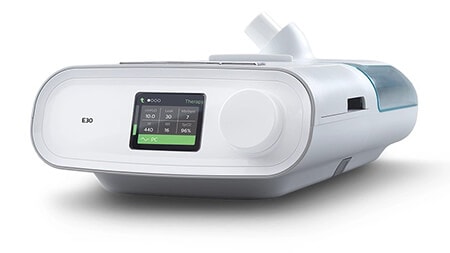
E30
(Autorizaţie pentru utilizare de urgenţă)

DreamStation ASV
De asemenea, cunoscut caDreamStation BiPAP autoSV

DreamStation ST, AVAPS
De asemenea, cunoscut ca DreamStation BiPAP AVAPS, DreamStation BiPAP S/T

SystemOne ASV4
De asemenea, cunoscut ca System One BiPAP autoSV,System One BiPAP autoSV Advanced

AVAPS/AVAPS seria C
De asemenea, cunoscut ca System One BiPAP AVAPS (seria C),System One BiPAP S/T (seria C)

OmniLab Advanced Plus
Dispozitiv de titrare în laborator

System One 50 series
CPAP, Auto CPAP, BiPAP

System One 60 series
CPAP, Auto CPAP, BiPAP

DreamStation CPAP, Auto CPAP, BiPAP

DreamStation GO CPAP, APAP, Auto CPAP

Dorma 400, 500 CPAP, Auto CPAP
(nu este comercializat în S.U.A.)
Dacă dispozitivul dumneavoastră este afectat...
Ventilator cu funcţionare continuă, Suport minim al ventilatorului, Utilizare în instituţie

A-Series BiPAP Hybrid A30
De asemenea, cunoscut caVentilatorBiPAP Hybrid A30(seria A)
(nu este comercializat în S.U.A.)

Ventilator seria A BiPAP V30 Auto
De asemenea, cunoscut ca Ventilator BiPAP V30 Auto(seria A)
Ventilator cu funcţionare continuă, nu susţine funcţiile vitale

A-Series BiPAP A40
De asemenea, cunoscut ca VentilatorBiPAP A40 (Seria A)
(nu este comercializat în S.U.A)

A-Series BiPAP A30
De asemenea, cunoscut caBiPAP A30 Ventilator (Seria A)
nu este comercializat în S.U.A)
Dacă dispozitivul dumneavoastră este afectat...
Ce produse nu sunt afectate şi de ce?
Produsele care nu sunt afectate pot avea materiale din spumă pentru amortizarea sunetului diferită, fiind materiale si tehnologii noi ce au fost au fost disponibile ulterior. De asemenea, spuma pentru amortizarea sunetului folosită în dispozitivele neafectate poate fi instalată într-un loc diferit datorită designului dispozitivului.